ESTUDOS INTERDISCIPLINARES EM QUÍMICA
Reações com energia livre de Gibbs negativo liberam energia livre e são chamadas de reações exergônicas, o que significa que os reagentes, têm mais energia livre que os produtos. Já em reações com energia livre de Gibbs positivo, por sua vez, precisam de entrada de energia e são chamadas de reações endergônicas, o que significa que os produtos, têm mais energia livre que os reagentes
Os gráficos abaixo representam valores de Energia livre de Gibbs, de acordo com a extensão da reação, em três situações distintas.
 Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
Com relação a esse tema, assinale a opção que descreve corretamente o comportamento representado em cada um dos gráficos acima.
No gráfico I, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos e os reagentes são igualmente favorecidos.
No gráfico I, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos são favorecidos em relação aos reagentes.
No gráfico I, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico II, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico III, os produtos e os reagentes são favorecidos de forma aproximada.
No gráfico I, a reação não está em equilíbrio e os reagentes são favorecidos em relação aos produtos; no gráfico II, areação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação é espontânea e os produtos e reagentes são igualmente favorecidos.
No gráfico I, a reação é endotérmica e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é exotérmica e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes.
O ozônio tem grande importância nos processos que ocorrem na troposfera. Um mecanismo proposto para a sua decomposição na atmosfera, na ausência de poluentes, é apresentado a seguir.
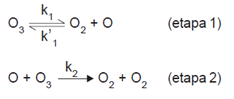
Alguns processos químicos ocorrem em várias etapas. As reações globais são as que ocorrem em mais de uma etapa. A velocidade desta reação depende da velocidade das etapas participantes. Quando isto acontecer, determina-se a velocidade da reação através da etapa lenta.
Considerando que a etapa lenta do processo é a 2, qual é a relação de dependência existente entre a velocidade de decomposição do ozônio e as concentrações das espécies envolvidas?
A velocidade é diretamente proporcional à concentração de O3.
A velocidade é diretamente proporcional à concentração de O2.
A velocidade não depende da concentração de O2.
A velocidade é inversamente proporcional à concentração de O2.
A velocidade é inversamente proporcional à concentração de O3.
A termodinâmica é uma ciência experimental, pois a partir da observação de alguns fenômenos físico-químicos foram elaboradas leis básicas, conhecidas como a Lei Zero, a Primeira, a Segunda e a Terceira Leis da Termodinâmica. Está ciência é a área da Química que se dedica ao estudo das transformações de energia e o entendimento da primeira lei da termodinâmica envolve a compreensão de algumas formas de energia, tais como o calor e trabalho.
A respeito da primeira lei da termodinâmica, avalie as afirmações a seguir.
- A energia interna permanece constante independente de qual seja o sistema de estudo.
- Em um processo de expansão livre em que não há trocas de calor com a vizinhança, a energia interna do sistema diminui.
- A variação de energia interna de um sistema fechado é igual à energia transferida como calor ou trabalho através de suas fronteiras.
- Para processos adiabáticos, a variação da energia interna está associada ao trabalho realizado pelo sistema ou sobre o sistema.
É correto apenas o que se afirma em:
I, II e IV
I, III e IV
III e IV
I e II
II e III
A crosta terrestre, que é formada por uma camada fina na superfície do planeta, é formada por rochas sólidas constituídas por oxigênio, silício, alumínio, magnésio e ferro. Todos esses metais apresentam grande aplicação industrial e cada apresenta propriedades específicas. Com relação às propriedades do alumínio, pode-se afirmar que:
I - seu íon Al3+ tem forte efeito polarizante;
II - forma o íon Al3+ que é paramagnético;
III - pode ser obtido pela eletrólise ígnea da bauxita;
IV - seus haletos agem como Ácidos de Lewis.
São corretas apenas as afirmações:
II e IV.
I, III e IV.
II, III e IV.
III e IV.
I, II e III.
De acordo com a OMS (Organização Mundial de Saúde), todo ser humano deve ter acesso à água tratada para seu consumo.
O tratamento de água consiste em um conjunto de procedimentos físicos e químicos que são aplicados na água, para que esta fique em condições adequadas para o consumo, ou seja, para que a água se torne potável. Esse processo de tratamento de água a livra de qualquer tipo de contaminação, evitando a transmissão de doenças.
Em uma das etapas do tratamento de água ocorre a adsorção de partículas em uma massa gelatinosa constituída de hidróxido de alumínio. Esta substância é preparada pela adição de Ca(OH)2 e Al2(SO4)3 à água contida em tanques de tratamento, de acordo com a equação (1):
Ca(OH)2 + Al2(SO4)3 ---> 2 Al(OH)3 + 3 CaSO4 (1)
O hidróxido de cálcio, por sua vez é obtido através das reações 2 e 3, demosntradas abaixo:
CaCO3 ---------> CaO + CO2 (2)
CaO + H2O -------> Ca(OH)2 (3)
Considere que uma amostra de 50 g de calcário contenha 10 g de carbonato de cálcio, que a obtenção do óxido de cálcio é de 50% do carbonato de cálcio e que todo óxido de cálcio se transforma em hidróxido de cálcio. Considere, ainda, os dados: O (A = 16), Ca (A = 40), H (A = 1) e C (A = 12)
Com base nessas informações, caso uma indústria de transformação necessite da fabricação de 740 toneladas de hidróxido de cálcio, quantas toneladas do calcário serão necessárias para essa produção?
560
20 000
2 000
1 000
10 000
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
P4
P3
P2
P1
P5
O estudo dos materiais é muito importante para o desenvolvimento da sociedade, de maneira geral. Materiais metálicos, cerâmicos e poliméricos são amplamente utilizados nos dias de hoje e suas aplicações estão diretamente relacionadas às suas propriedades químicas e físicas.
Com relação à estrutura e às propriedades desses materiais, analise as afirmações a seguir.
I. Todos os materiais metálicos, cerâmicos e polímeros cristalizam-se quando solidificam. Seus átomos se arranjam em um modelo ordenado e repetido, chamado estrutura cristalina.
II. As propriedades dos materiais sólidos cristalinos dependem da sua estrutura cristalina, ou seja, da maneira pela qual os átomos, moléculas ou íons encontram-se espacialmente dispostos.
III. Os materiais metálicos (Fe, Al, aço, latão) são bons condutores de eletricidade e de calor, resistentes e, em determinadas condições, deformáveis, enquanto os materiais cerâmicos (porcelana, cimento) são duros e quebradiços.
IV. Os polímeros comuns de plásticos e borrachas possuem elevada massa molecular, flexibilidade e alta densidade, comparável a outros materiais como o chumbo (11,3 g/cm3).
É correto apenas o que se afirma em
I e IV
I e II
II, III e IV
II e III
I, III e IV
Um movimento ecológico preocupado com as condições da água de um rio situado em uma área de grande aglomeração urbana resolve fazer uma campanha para conscientizar a população a utilizar detergentes em pó com parcimônia. Para tal, encomenda a uma empresa que analise o teor de fósforo em amostras de detergentes em pó de três fabricantes da região, os quais contêm tripolifosfato de sódio, Na5P3O10, utilizado para promover o abrandamento da dureza das águas. O teor de fósforo no detergente em pó foi determinado por gravimetria. O método consiste em tratar a amostra com excesso de molibdato de amônio, precipitando o fósforo na forma de (NH4)3PMo12O40. O precipitado lavado e livre de interferentes é dissolvido em solução de NH3(aq) e reprecipitado como MgNH4PO4.6H2O, que, sob calcinação, se converte em pirofosfato de magnésio, Mg2P2O7(s). A análise em triplicata forneceu os seguintes resultados:

Sabendo que a Resolução do CONAMA estabelece o valor de 4,80% como limite máximo de fósforo no produto, o(s) fabricante(s) que forneceu(ram) amostra(s) em conformidade com esta Resolução é(são) APENAS
Dados: Massa molar do Mg2P2O7 = 222 g/mol e massa molar do fósforo = 31 g/mol.

No gráfico I, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos e os reagentes são igualmente favorecidos.
No gráfico I, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, os produtos são favorecidos em relação aos reagentes.
No gráfico I, a reação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico II, a reação é espontânea e os produtos são favorecidos em relação aos reagentes; no gráfico III, os produtos e os reagentes são favorecidos de forma aproximada.
No gráfico I, a reação não está em equilíbrio e os reagentes são favorecidos em relação aos produtos; no gráfico II, areação não é espontânea e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação é espontânea e os produtos e reagentes são igualmente favorecidos.
No gráfico I, a reação é endotérmica e os produtos são favorecidos em relação aos reagentes; no gráfico II, a reação é exotérmica e os reagentes são favorecidos em relação aos produtos; no gráfico III, a reação não é espontânea e os produtos são favorecidos em relação aos reagentes.
O ozônio tem grande importância nos processos que ocorrem na troposfera. Um mecanismo proposto para a sua decomposição na atmosfera, na ausência de poluentes, é apresentado a seguir.
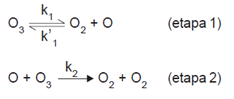
Alguns processos químicos ocorrem em várias etapas. As reações globais são as que ocorrem em mais de uma etapa. A velocidade desta reação depende da velocidade das etapas participantes. Quando isto acontecer, determina-se a velocidade da reação através da etapa lenta.
Considerando que a etapa lenta do processo é a 2, qual é a relação de dependência existente entre a velocidade de decomposição do ozônio e as concentrações das espécies envolvidas?
A velocidade é diretamente proporcional à concentração de O3.
A velocidade é diretamente proporcional à concentração de O2.
A velocidade não depende da concentração de O2.
A velocidade é inversamente proporcional à concentração de O2.
A velocidade é inversamente proporcional à concentração de O3.
A termodinâmica é uma ciência experimental, pois a partir da observação de alguns fenômenos físico-químicos foram elaboradas leis básicas, conhecidas como a Lei Zero, a Primeira, a Segunda e a Terceira Leis da Termodinâmica. Está ciência é a área da Química que se dedica ao estudo das transformações de energia e o entendimento da primeira lei da termodinâmica envolve a compreensão de algumas formas de energia, tais como o calor e trabalho.
A respeito da primeira lei da termodinâmica, avalie as afirmações a seguir.
- A energia interna permanece constante independente de qual seja o sistema de estudo.
- Em um processo de expansão livre em que não há trocas de calor com a vizinhança, a energia interna do sistema diminui.
- A variação de energia interna de um sistema fechado é igual à energia transferida como calor ou trabalho através de suas fronteiras.
- Para processos adiabáticos, a variação da energia interna está associada ao trabalho realizado pelo sistema ou sobre o sistema.
É correto apenas o que se afirma em:
I, II e IV
I, III e IV
III e IV
I e II
II e III
A crosta terrestre, que é formada por uma camada fina na superfície do planeta, é formada por rochas sólidas constituídas por oxigênio, silício, alumínio, magnésio e ferro. Todos esses metais apresentam grande aplicação industrial e cada apresenta propriedades específicas. Com relação às propriedades do alumínio, pode-se afirmar que:
I - seu íon Al3+ tem forte efeito polarizante;
II - forma o íon Al3+ que é paramagnético;
III - pode ser obtido pela eletrólise ígnea da bauxita;
IV - seus haletos agem como Ácidos de Lewis.
São corretas apenas as afirmações:
II e IV.
I, III e IV.
II, III e IV.
III e IV.
I, II e III.
De acordo com a OMS (Organização Mundial de Saúde), todo ser humano deve ter acesso à água tratada para seu consumo.
O tratamento de água consiste em um conjunto de procedimentos físicos e químicos que são aplicados na água, para que esta fique em condições adequadas para o consumo, ou seja, para que a água se torne potável. Esse processo de tratamento de água a livra de qualquer tipo de contaminação, evitando a transmissão de doenças.
Em uma das etapas do tratamento de água ocorre a adsorção de partículas em uma massa gelatinosa constituída de hidróxido de alumínio. Esta substância é preparada pela adição de Ca(OH)2 e Al2(SO4)3 à água contida em tanques de tratamento, de acordo com a equação (1):
Ca(OH)2 + Al2(SO4)3 ---> 2 Al(OH)3 + 3 CaSO4 (1)
O hidróxido de cálcio, por sua vez é obtido através das reações 2 e 3, demosntradas abaixo:
CaCO3 ---------> CaO + CO2 (2)
CaO + H2O -------> Ca(OH)2 (3)
Considere que uma amostra de 50 g de calcário contenha 10 g de carbonato de cálcio, que a obtenção do óxido de cálcio é de 50% do carbonato de cálcio e que todo óxido de cálcio se transforma em hidróxido de cálcio. Considere, ainda, os dados: O (A = 16), Ca (A = 40), H (A = 1) e C (A = 12)
Com base nessas informações, caso uma indústria de transformação necessite da fabricação de 740 toneladas de hidróxido de cálcio, quantas toneladas do calcário serão necessárias para essa produção?
560
20 000
2 000
1 000
10 000
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
P4
P3
P2
P1
P5
O estudo dos materiais é muito importante para o desenvolvimento da sociedade, de maneira geral. Materiais metálicos, cerâmicos e poliméricos são amplamente utilizados nos dias de hoje e suas aplicações estão diretamente relacionadas às suas propriedades químicas e físicas.
Com relação à estrutura e às propriedades desses materiais, analise as afirmações a seguir.
I. Todos os materiais metálicos, cerâmicos e polímeros cristalizam-se quando solidificam. Seus átomos se arranjam em um modelo ordenado e repetido, chamado estrutura cristalina.
II. As propriedades dos materiais sólidos cristalinos dependem da sua estrutura cristalina, ou seja, da maneira pela qual os átomos, moléculas ou íons encontram-se espacialmente dispostos.
III. Os materiais metálicos (Fe, Al, aço, latão) são bons condutores de eletricidade e de calor, resistentes e, em determinadas condições, deformáveis, enquanto os materiais cerâmicos (porcelana, cimento) são duros e quebradiços.
IV. Os polímeros comuns de plásticos e borrachas possuem elevada massa molecular, flexibilidade e alta densidade, comparável a outros materiais como o chumbo (11,3 g/cm3).
É correto apenas o que se afirma em
I e IV
I e II
II, III e IV
II e III
I, III e IV
Um movimento ecológico preocupado com as condições da água de um rio situado em uma área de grande aglomeração urbana resolve fazer uma campanha para conscientizar a população a utilizar detergentes em pó com parcimônia. Para tal, encomenda a uma empresa que analise o teor de fósforo em amostras de detergentes em pó de três fabricantes da região, os quais contêm tripolifosfato de sódio, Na5P3O10, utilizado para promover o abrandamento da dureza das águas. O teor de fósforo no detergente em pó foi determinado por gravimetria. O método consiste em tratar a amostra com excesso de molibdato de amônio, precipitando o fósforo na forma de (NH4)3PMo12O40. O precipitado lavado e livre de interferentes é dissolvido em solução de NH3(aq) e reprecipitado como MgNH4PO4.6H2O, que, sob calcinação, se converte em pirofosfato de magnésio, Mg2P2O7(s). A análise em triplicata forneceu os seguintes resultados:

Sabendo que a Resolução do CONAMA estabelece o valor de 4,80% como limite máximo de fósforo no produto, o(s) fabricante(s) que forneceu(ram) amostra(s) em conformidade com esta Resolução é(são) APENAS
Dados: Massa molar do Mg2P2O7 = 222 g/mol e massa molar do fósforo = 31 g/mol.
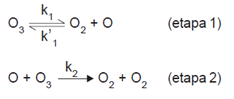
Alguns processos químicos ocorrem em várias etapas. As reações globais são as que ocorrem em mais de uma etapa. A velocidade desta reação depende da velocidade das etapas participantes. Quando isto acontecer, determina-se a velocidade da reação através da etapa lenta.
Considerando que a etapa lenta do processo é a 2, qual é a relação de dependência existente entre a velocidade de decomposição do ozônio e as concentrações das espécies envolvidas?A velocidade é diretamente proporcional à concentração de O3.
A velocidade é diretamente proporcional à concentração de O2.
A velocidade não depende da concentração de O2.
A velocidade é inversamente proporcional à concentração de O2.
A velocidade é inversamente proporcional à concentração de O3.
A termodinâmica é uma ciência experimental, pois a partir da observação de alguns fenômenos físico-químicos foram elaboradas leis básicas, conhecidas como a Lei Zero, a Primeira, a Segunda e a Terceira Leis da Termodinâmica. Está ciência é a área da Química que se dedica ao estudo das transformações de energia e o entendimento da primeira lei da termodinâmica envolve a compreensão de algumas formas de energia, tais como o calor e trabalho.
A respeito da primeira lei da termodinâmica, avalie as afirmações a seguir.
- A energia interna permanece constante independente de qual seja o sistema de estudo.
- Em um processo de expansão livre em que não há trocas de calor com a vizinhança, a energia interna do sistema diminui.
- A variação de energia interna de um sistema fechado é igual à energia transferida como calor ou trabalho através de suas fronteiras.
- Para processos adiabáticos, a variação da energia interna está associada ao trabalho realizado pelo sistema ou sobre o sistema.
É correto apenas o que se afirma em:
I, II e IV
I, III e IV
III e IV
I e II
II e III
A crosta terrestre, que é formada por uma camada fina na superfície do planeta, é formada por rochas sólidas constituídas por oxigênio, silício, alumínio, magnésio e ferro. Todos esses metais apresentam grande aplicação industrial e cada apresenta propriedades específicas. Com relação às propriedades do alumínio, pode-se afirmar que:
I - seu íon Al3+ tem forte efeito polarizante;
II - forma o íon Al3+ que é paramagnético;
III - pode ser obtido pela eletrólise ígnea da bauxita;
IV - seus haletos agem como Ácidos de Lewis.
São corretas apenas as afirmações:
II e IV.
I, III e IV.
II, III e IV.
III e IV.
I, II e III.
De acordo com a OMS (Organização Mundial de Saúde), todo ser humano deve ter acesso à água tratada para seu consumo.
O tratamento de água consiste em um conjunto de procedimentos físicos e químicos que são aplicados na água, para que esta fique em condições adequadas para o consumo, ou seja, para que a água se torne potável. Esse processo de tratamento de água a livra de qualquer tipo de contaminação, evitando a transmissão de doenças.
Em uma das etapas do tratamento de água ocorre a adsorção de partículas em uma massa gelatinosa constituída de hidróxido de alumínio. Esta substância é preparada pela adição de Ca(OH)2 e Al2(SO4)3 à água contida em tanques de tratamento, de acordo com a equação (1):
Ca(OH)2 + Al2(SO4)3 ---> 2 Al(OH)3 + 3 CaSO4 (1)
O hidróxido de cálcio, por sua vez é obtido através das reações 2 e 3, demosntradas abaixo:
CaCO3 ---------> CaO + CO2 (2)
CaO + H2O -------> Ca(OH)2 (3)
Considere que uma amostra de 50 g de calcário contenha 10 g de carbonato de cálcio, que a obtenção do óxido de cálcio é de 50% do carbonato de cálcio e que todo óxido de cálcio se transforma em hidróxido de cálcio. Considere, ainda, os dados: O (A = 16), Ca (A = 40), H (A = 1) e C (A = 12)
Com base nessas informações, caso uma indústria de transformação necessite da fabricação de 740 toneladas de hidróxido de cálcio, quantas toneladas do calcário serão necessárias para essa produção?
560
20 000
2 000
1 000
10 000
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
P4
P3
P2
P1
P5
O estudo dos materiais é muito importante para o desenvolvimento da sociedade, de maneira geral. Materiais metálicos, cerâmicos e poliméricos são amplamente utilizados nos dias de hoje e suas aplicações estão diretamente relacionadas às suas propriedades químicas e físicas.
Com relação à estrutura e às propriedades desses materiais, analise as afirmações a seguir.
I. Todos os materiais metálicos, cerâmicos e polímeros cristalizam-se quando solidificam. Seus átomos se arranjam em um modelo ordenado e repetido, chamado estrutura cristalina.
II. As propriedades dos materiais sólidos cristalinos dependem da sua estrutura cristalina, ou seja, da maneira pela qual os átomos, moléculas ou íons encontram-se espacialmente dispostos.
III. Os materiais metálicos (Fe, Al, aço, latão) são bons condutores de eletricidade e de calor, resistentes e, em determinadas condições, deformáveis, enquanto os materiais cerâmicos (porcelana, cimento) são duros e quebradiços.
IV. Os polímeros comuns de plásticos e borrachas possuem elevada massa molecular, flexibilidade e alta densidade, comparável a outros materiais como o chumbo (11,3 g/cm3).
É correto apenas o que se afirma em
I e IV
I e II
II, III e IV
II e III
I, III e IV
Um movimento ecológico preocupado com as condições da água de um rio situado em uma área de grande aglomeração urbana resolve fazer uma campanha para conscientizar a população a utilizar detergentes em pó com parcimônia. Para tal, encomenda a uma empresa que analise o teor de fósforo em amostras de detergentes em pó de três fabricantes da região, os quais contêm tripolifosfato de sódio, Na5P3O10, utilizado para promover o abrandamento da dureza das águas. O teor de fósforo no detergente em pó foi determinado por gravimetria. O método consiste em tratar a amostra com excesso de molibdato de amônio, precipitando o fósforo na forma de (NH4)3PMo12O40. O precipitado lavado e livre de interferentes é dissolvido em solução de NH3(aq) e reprecipitado como MgNH4PO4.6H2O, que, sob calcinação, se converte em pirofosfato de magnésio, Mg2P2O7(s). A análise em triplicata forneceu os seguintes resultados:

Sabendo que a Resolução do CONAMA estabelece o valor de 4,80% como limite máximo de fósforo no produto, o(s) fabricante(s) que forneceu(ram) amostra(s) em conformidade com esta Resolução é(são) APENAS
Dados: Massa molar do Mg2P2O7 = 222 g/mol e massa molar do fósforo = 31 g/mol.
I, II e IV
I, III e IV
III e IV
I e II
II e III
A crosta terrestre, que é formada por uma camada fina na superfície do planeta, é formada por rochas sólidas constituídas por oxigênio, silício, alumínio, magnésio e ferro. Todos esses metais apresentam grande aplicação industrial e cada apresenta propriedades específicas. Com relação às propriedades do alumínio, pode-se afirmar que:
I - seu íon Al3+ tem forte efeito polarizante;
II - forma o íon Al3+ que é paramagnético;
III - pode ser obtido pela eletrólise ígnea da bauxita;
IV - seus haletos agem como Ácidos de Lewis.
São corretas apenas as afirmações:
II e IV.
I, III e IV.
II, III e IV.
III e IV.
I, II e III.
De acordo com a OMS (Organização Mundial de Saúde), todo ser humano deve ter acesso à água tratada para seu consumo.
O tratamento de água consiste em um conjunto de procedimentos físicos e químicos que são aplicados na água, para que esta fique em condições adequadas para o consumo, ou seja, para que a água se torne potável. Esse processo de tratamento de água a livra de qualquer tipo de contaminação, evitando a transmissão de doenças.
Em uma das etapas do tratamento de água ocorre a adsorção de partículas em uma massa gelatinosa constituída de hidróxido de alumínio. Esta substância é preparada pela adição de Ca(OH)2 e Al2(SO4)3 à água contida em tanques de tratamento, de acordo com a equação (1):
Ca(OH)2 + Al2(SO4)3 ---> 2 Al(OH)3 + 3 CaSO4 (1)
O hidróxido de cálcio, por sua vez é obtido através das reações 2 e 3, demosntradas abaixo:
CaCO3 ---------> CaO + CO2 (2)
CaO + H2O -------> Ca(OH)2 (3)
Considere que uma amostra de 50 g de calcário contenha 10 g de carbonato de cálcio, que a obtenção do óxido de cálcio é de 50% do carbonato de cálcio e que todo óxido de cálcio se transforma em hidróxido de cálcio. Considere, ainda, os dados: O (A = 16), Ca (A = 40), H (A = 1) e C (A = 12)
Com base nessas informações, caso uma indústria de transformação necessite da fabricação de 740 toneladas de hidróxido de cálcio, quantas toneladas do calcário serão necessárias para essa produção?
560
20 000
2 000
1 000
10 000
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
P4
P3
P2
P1
P5
O estudo dos materiais é muito importante para o desenvolvimento da sociedade, de maneira geral. Materiais metálicos, cerâmicos e poliméricos são amplamente utilizados nos dias de hoje e suas aplicações estão diretamente relacionadas às suas propriedades químicas e físicas.
Com relação à estrutura e às propriedades desses materiais, analise as afirmações a seguir.
I. Todos os materiais metálicos, cerâmicos e polímeros cristalizam-se quando solidificam. Seus átomos se arranjam em um modelo ordenado e repetido, chamado estrutura cristalina.
II. As propriedades dos materiais sólidos cristalinos dependem da sua estrutura cristalina, ou seja, da maneira pela qual os átomos, moléculas ou íons encontram-se espacialmente dispostos.
III. Os materiais metálicos (Fe, Al, aço, latão) são bons condutores de eletricidade e de calor, resistentes e, em determinadas condições, deformáveis, enquanto os materiais cerâmicos (porcelana, cimento) são duros e quebradiços.
IV. Os polímeros comuns de plásticos e borrachas possuem elevada massa molecular, flexibilidade e alta densidade, comparável a outros materiais como o chumbo (11,3 g/cm3).
É correto apenas o que se afirma em
I e IV
I e II
II, III e IV
II e III
I, III e IV
Um movimento ecológico preocupado com as condições da água de um rio situado em uma área de grande aglomeração urbana resolve fazer uma campanha para conscientizar a população a utilizar detergentes em pó com parcimônia. Para tal, encomenda a uma empresa que analise o teor de fósforo em amostras de detergentes em pó de três fabricantes da região, os quais contêm tripolifosfato de sódio, Na5P3O10, utilizado para promover o abrandamento da dureza das águas. O teor de fósforo no detergente em pó foi determinado por gravimetria. O método consiste em tratar a amostra com excesso de molibdato de amônio, precipitando o fósforo na forma de (NH4)3PMo12O40. O precipitado lavado e livre de interferentes é dissolvido em solução de NH3(aq) e reprecipitado como MgNH4PO4.6H2O, que, sob calcinação, se converte em pirofosfato de magnésio, Mg2P2O7(s). A análise em triplicata forneceu os seguintes resultados:

Sabendo que a Resolução do CONAMA estabelece o valor de 4,80% como limite máximo de fósforo no produto, o(s) fabricante(s) que forneceu(ram) amostra(s) em conformidade com esta Resolução é(são) APENAS
Dados: Massa molar do Mg2P2O7 = 222 g/mol e massa molar do fósforo = 31 g/mol.
II e IV.
I, III e IV.
II, III e IV.
III e IV.
I, II e III.
De acordo com a OMS (Organização Mundial de Saúde), todo ser humano deve ter acesso à água tratada para seu consumo.
O tratamento de água consiste em um conjunto de procedimentos físicos e químicos que são aplicados na água, para que esta fique em condições adequadas para o consumo, ou seja, para que a água se torne potável. Esse processo de tratamento de água a livra de qualquer tipo de contaminação, evitando a transmissão de doenças.
Em uma das etapas do tratamento de água ocorre a adsorção de partículas em uma massa gelatinosa constituída de hidróxido de alumínio. Esta substância é preparada pela adição de Ca(OH)2 e Al2(SO4)3 à água contida em tanques de tratamento, de acordo com a equação (1):
Ca(OH)2 + Al2(SO4)3 ---> 2 Al(OH)3 + 3 CaSO4 (1)
O hidróxido de cálcio, por sua vez é obtido através das reações 2 e 3, demosntradas abaixo:
CaCO3 ---------> CaO + CO2 (2)
CaO + H2O -------> Ca(OH)2 (3)
Considere que uma amostra de 50 g de calcário contenha 10 g de carbonato de cálcio, que a obtenção do óxido de cálcio é de 50% do carbonato de cálcio e que todo óxido de cálcio se transforma em hidróxido de cálcio. Considere, ainda, os dados: O (A = 16), Ca (A = 40), H (A = 1) e C (A = 12)
Com base nessas informações, caso uma indústria de transformação necessite da fabricação de 740 toneladas de hidróxido de cálcio, quantas toneladas do calcário serão necessárias para essa produção?
560
20 000
2 000
1 000
10 000
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
P4
P3
P2
P1
P5
O estudo dos materiais é muito importante para o desenvolvimento da sociedade, de maneira geral. Materiais metálicos, cerâmicos e poliméricos são amplamente utilizados nos dias de hoje e suas aplicações estão diretamente relacionadas às suas propriedades químicas e físicas.
Com relação à estrutura e às propriedades desses materiais, analise as afirmações a seguir.
I. Todos os materiais metálicos, cerâmicos e polímeros cristalizam-se quando solidificam. Seus átomos se arranjam em um modelo ordenado e repetido, chamado estrutura cristalina.
II. As propriedades dos materiais sólidos cristalinos dependem da sua estrutura cristalina, ou seja, da maneira pela qual os átomos, moléculas ou íons encontram-se espacialmente dispostos.
III. Os materiais metálicos (Fe, Al, aço, latão) são bons condutores de eletricidade e de calor, resistentes e, em determinadas condições, deformáveis, enquanto os materiais cerâmicos (porcelana, cimento) são duros e quebradiços.
IV. Os polímeros comuns de plásticos e borrachas possuem elevada massa molecular, flexibilidade e alta densidade, comparável a outros materiais como o chumbo (11,3 g/cm3).
É correto apenas o que se afirma em
I e IV
I e II
II, III e IV
II e III
I, III e IV
Um movimento ecológico preocupado com as condições da água de um rio situado em uma área de grande aglomeração urbana resolve fazer uma campanha para conscientizar a população a utilizar detergentes em pó com parcimônia. Para tal, encomenda a uma empresa que analise o teor de fósforo em amostras de detergentes em pó de três fabricantes da região, os quais contêm tripolifosfato de sódio, Na5P3O10, utilizado para promover o abrandamento da dureza das águas. O teor de fósforo no detergente em pó foi determinado por gravimetria. O método consiste em tratar a amostra com excesso de molibdato de amônio, precipitando o fósforo na forma de (NH4)3PMo12O40. O precipitado lavado e livre de interferentes é dissolvido em solução de NH3(aq) e reprecipitado como MgNH4PO4.6H2O, que, sob calcinação, se converte em pirofosfato de magnésio, Mg2P2O7(s). A análise em triplicata forneceu os seguintes resultados:

Sabendo que a Resolução do CONAMA estabelece o valor de 4,80% como limite máximo de fósforo no produto, o(s) fabricante(s) que forneceu(ram) amostra(s) em conformidade com esta Resolução é(são) APENAS
Dados: Massa molar do Mg2P2O7 = 222 g/mol e massa molar do fósforo = 31 g/mol.
560
20 000
2 000
1 000
10 000
Os coloides, ou também chamados sistemas coloidais, são sistemas que apresentam um ou mais componentes possuindo dimensões entre 1 nm a 1 µm. Podemos citar como exemplos de sistemas coloidais o mel, gelatina, maionese, sangue, etc., muitos deles sendo confundidos, erroneamente, com soluções.
Um exemplo claro desse erro de análise ocorre quando misturamos detergente à água, formando um sistema coloidal. Analisando mais profundamente a química dos coloides, podemos afirmar corretamente que:
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
P4
P3
P2
P1
P5
O estudo dos materiais é muito importante para o desenvolvimento da sociedade, de maneira geral. Materiais metálicos, cerâmicos e poliméricos são amplamente utilizados nos dias de hoje e suas aplicações estão diretamente relacionadas às suas propriedades químicas e físicas.
Com relação à estrutura e às propriedades desses materiais, analise as afirmações a seguir.
I. Todos os materiais metálicos, cerâmicos e polímeros cristalizam-se quando solidificam. Seus átomos se arranjam em um modelo ordenado e repetido, chamado estrutura cristalina.
II. As propriedades dos materiais sólidos cristalinos dependem da sua estrutura cristalina, ou seja, da maneira pela qual os átomos, moléculas ou íons encontram-se espacialmente dispostos.
III. Os materiais metálicos (Fe, Al, aço, latão) são bons condutores de eletricidade e de calor, resistentes e, em determinadas condições, deformáveis, enquanto os materiais cerâmicos (porcelana, cimento) são duros e quebradiços.
IV. Os polímeros comuns de plásticos e borrachas possuem elevada massa molecular, flexibilidade e alta densidade, comparável a outros materiais como o chumbo (11,3 g/cm3).
É correto apenas o que se afirma em
I e IV
I e II
II, III e IV
II e III
I, III e IV
Um movimento ecológico preocupado com as condições da água de um rio situado em uma área de grande aglomeração urbana resolve fazer uma campanha para conscientizar a população a utilizar detergentes em pó com parcimônia. Para tal, encomenda a uma empresa que analise o teor de fósforo em amostras de detergentes em pó de três fabricantes da região, os quais contêm tripolifosfato de sódio, Na5P3O10, utilizado para promover o abrandamento da dureza das águas. O teor de fósforo no detergente em pó foi determinado por gravimetria. O método consiste em tratar a amostra com excesso de molibdato de amônio, precipitando o fósforo na forma de (NH4)3PMo12O40. O precipitado lavado e livre de interferentes é dissolvido em solução de NH3(aq) e reprecipitado como MgNH4PO4.6H2O, que, sob calcinação, se converte em pirofosfato de magnésio, Mg2P2O7(s). A análise em triplicata forneceu os seguintes resultados:

Sabendo que a Resolução do CONAMA estabelece o valor de 4,80% como limite máximo de fósforo no produto, o(s) fabricante(s) que forneceu(ram) amostra(s) em conformidade com esta Resolução é(são) APENAS
Dados: Massa molar do Mg2P2O7 = 222 g/mol e massa molar do fósforo = 31 g/mol.
uma maneira prática de diferenciar uma solução de uma dispersão coloidal é por meio do efeito Tyndall, observado somente em soluções.
as micelas são muito pequenas para serem vistas a olho nú e, por conta disso, não promovem o espalhamento da luz.
as partículas de coloides podem ser formadas tanto por agregados de moléculas, como por macromoléculas dispersas.
em meio aquoso, a porção hidrofílica das moléculas de detergente orientam-se na parte interna das micelas.
dispersões coloidais são mantidas estáveis, devido às atrações eletrostáticas que ocorrem entre a superfície das partículas coloidais.
Durante o acompanhamento da quantidade de matéria orgânica em um córrego, resultados de análises de amostras de 100 mL de água, recolhidas, ao longo de três meses, comprovaram a presença de, em média, 3,2 mg de matéria orgânica, na forma de glicose C6H12O6 (massa molar é 180 g/mol).
Com base nessas análises, 5 pareceres foram elaborados, por pessoas diferente:
P1: A qualidade da água tornou-se inadequada para sustentar a vida aquática e, nas atuais condições, apenas cerca de 25% da matéria orgânica pode ser decomposto.
P2: A qualidade da água do rio ainda é boa, uma vez que cerca de três quartos da matéria orgânica podem ser decompostos.
P3: Nas condições atuais, no máximo, 50% da matéria orgânica pode ser decomposto, e a manutenção da vida aquática fica comprometida.
P4: A qualidade da água do rio é boa. Há oxigênio na água suficiente para degradar toda a matéria orgânica e manter a vida aquática.
P5: A quantidade de matéria orgânica precisa ser reduzida a, aproximadamente, 2% dos níveis atuais para poder sustentar a vida aquática.
Ao analisar os relatórios, um químico levou em consideração os seguintes pontos:
a concentração mínima de O2 na água para sustentar a vida aquática é de 5 ppm, à temperatura média de 200 C;
a solubilidade do oxigênio em rios depende de vários fatores, mas para cálculos mais simples pode ser considerada igual a solubilidade do O2 em água, que é de 9 ppm, a 200 C e 1 atm.
Com base nesses ponto, o químico recomendou o relatório:
P4
P3
P2
P1
P5
O estudo dos materiais é muito importante para o desenvolvimento da sociedade, de maneira geral. Materiais metálicos, cerâmicos e poliméricos são amplamente utilizados nos dias de hoje e suas aplicações estão diretamente relacionadas às suas propriedades químicas e físicas.
Com relação à estrutura e às propriedades desses materiais, analise as afirmações a seguir.
I. Todos os materiais metálicos, cerâmicos e polímeros cristalizam-se quando solidificam. Seus átomos se arranjam em um modelo ordenado e repetido, chamado estrutura cristalina.
II. As propriedades dos materiais sólidos cristalinos dependem da sua estrutura cristalina, ou seja, da maneira pela qual os átomos, moléculas ou íons encontram-se espacialmente dispostos.
III. Os materiais metálicos (Fe, Al, aço, latão) são bons condutores de eletricidade e de calor, resistentes e, em determinadas condições, deformáveis, enquanto os materiais cerâmicos (porcelana, cimento) são duros e quebradiços.
IV. Os polímeros comuns de plásticos e borrachas possuem elevada massa molecular, flexibilidade e alta densidade, comparável a outros materiais como o chumbo (11,3 g/cm3).
É correto apenas o que se afirma em
I e IV
I e II
II, III e IV
II e III
I, III e IV
Um movimento ecológico preocupado com as condições da água de um rio situado em uma área de grande aglomeração urbana resolve fazer uma campanha para conscientizar a população a utilizar detergentes em pó com parcimônia. Para tal, encomenda a uma empresa que analise o teor de fósforo em amostras de detergentes em pó de três fabricantes da região, os quais contêm tripolifosfato de sódio, Na5P3O10, utilizado para promover o abrandamento da dureza das águas. O teor de fósforo no detergente em pó foi determinado por gravimetria. O método consiste em tratar a amostra com excesso de molibdato de amônio, precipitando o fósforo na forma de (NH4)3PMo12O40. O precipitado lavado e livre de interferentes é dissolvido em solução de NH3(aq) e reprecipitado como MgNH4PO4.6H2O, que, sob calcinação, se converte em pirofosfato de magnésio, Mg2P2O7(s). A análise em triplicata forneceu os seguintes resultados:

Sabendo que a Resolução do CONAMA estabelece o valor de 4,80% como limite máximo de fósforo no produto, o(s) fabricante(s) que forneceu(ram) amostra(s) em conformidade com esta Resolução é(são) APENAS
Dados: Massa molar do Mg2P2O7 = 222 g/mol e massa molar do fósforo = 31 g/mol.
P4
P3
P2
P1
P5
O estudo dos materiais é muito importante para o desenvolvimento da sociedade, de maneira geral. Materiais metálicos, cerâmicos e poliméricos são amplamente utilizados nos dias de hoje e suas aplicações estão diretamente relacionadas às suas propriedades químicas e físicas.
Com relação à estrutura e às propriedades desses materiais, analise as afirmações a seguir.
I. Todos os materiais metálicos, cerâmicos e polímeros cristalizam-se quando solidificam. Seus átomos se arranjam em um modelo ordenado e repetido, chamado estrutura cristalina.
II. As propriedades dos materiais sólidos cristalinos dependem da sua estrutura cristalina, ou seja, da maneira pela qual os átomos, moléculas ou íons encontram-se espacialmente dispostos.
III. Os materiais metálicos (Fe, Al, aço, latão) são bons condutores de eletricidade e de calor, resistentes e, em determinadas condições, deformáveis, enquanto os materiais cerâmicos (porcelana, cimento) são duros e quebradiços.
IV. Os polímeros comuns de plásticos e borrachas possuem elevada massa molecular, flexibilidade e alta densidade, comparável a outros materiais como o chumbo (11,3 g/cm3).
É correto apenas o que se afirma em
I e IV
I e II
II, III e IV
II e III
I, III e IV
Um movimento ecológico preocupado com as condições da água de um rio situado em uma área de grande aglomeração urbana resolve fazer uma campanha para conscientizar a população a utilizar detergentes em pó com parcimônia. Para tal, encomenda a uma empresa que analise o teor de fósforo em amostras de detergentes em pó de três fabricantes da região, os quais contêm tripolifosfato de sódio, Na5P3O10, utilizado para promover o abrandamento da dureza das águas. O teor de fósforo no detergente em pó foi determinado por gravimetria. O método consiste em tratar a amostra com excesso de molibdato de amônio, precipitando o fósforo na forma de (NH4)3PMo12O40. O precipitado lavado e livre de interferentes é dissolvido em solução de NH3(aq) e reprecipitado como MgNH4PO4.6H2O, que, sob calcinação, se converte em pirofosfato de magnésio, Mg2P2O7(s). A análise em triplicata forneceu os seguintes resultados:

Sabendo que a Resolução do CONAMA estabelece o valor de 4,80% como limite máximo de fósforo no produto, o(s) fabricante(s) que forneceu(ram) amostra(s) em conformidade com esta Resolução é(são) APENAS
Dados: Massa molar do Mg2P2O7 = 222 g/mol e massa molar do fósforo = 31 g/mol.
I e IV
I e II
II, III e IV
II e III
I, III e IV